
透射电镜(Transmission Electron Microscope,TEM),全称透射电子显微镜,是把经加速和聚集的电子束投射到超薄切片的样品上(通常70-90nm),电子与样品中的原子碰撞而改变方向,从而产生立体角散射。散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像,影像将在放大、聚焦后在成像器件上显示出来。是一种高分辨率(0.1nm-0.2nm)、高放大倍数(0.2K-600K)的显微镜。是观察和研究物质超微结构的强有力工具。
透射电镜在细胞生物学、组织学、病毒学、病理学、分子生物学、材料科学等诸多领域具有广泛应用。可以观测动物植物细胞超微结构,如线粒体、内质网、高尔基体、溶酶体、叶绿体、液泡、细胞内生细菌等结构及病理变化。可以观测病毒颗粒、外泌体、病原微生物、各类细菌真菌、纳米材料及纳米颗粒、晶体结构。
1、平台主要设备:超薄切片机Leica EM UC7,透射电镜HITACHI HT7800 120kV。
HT7800系列产品的最大特点是采用日立最新设计的第二代双隙物镜,很好地继承了日立120kV-TEM的基本理念,兼顾低倍率与宽视野观察、高衬度与高分辨率观察,可在同一仪器上一键切换等。集高衬度和高分辨两种模式于一体,可同时满足软材料/纳米材料类和生命科学类客户对电镜的需求。
HT7800使用高速高灵敏度的CMOS荧光屏相机取代了传统的荧光屏观察窗,将 TEM 操作统一于显示器上,实现透射电镜操作的全数字化,可以在明亮的室内进行观察。这样,既可以保护操作者和样品,也可以显著改善操作环境。
2、透射电镜HITACHI HT7800主要技术指标:
(1)分辨率(晶格):0.2nm(120kV,off-axis)。
(2)放大倍数:(HC模式) ×200~×200,000;(HR模式) ×4,000~×600,000;(低倍模式) ×50~×1,000
由电子枪发射出来的电子束,在真空通道中沿着镜体光轴穿越聚光镜,通过聚光镜将之汇聚成一束尖细、明亮而又均匀的光斑,照射在样品室内的样品上里透过样品后的电子束携带有样品内部的结构信息,样品内致密处透过的电子量少,稀疏处透过的电子量多;经过物镜的会聚调焦和初级放大后,电子束进入下级的中间透镜和第1、第2投影镜进行综合放大成像,最终被放大了的电子影像投射在观察室内的荧光屏上;荧光屏将电子影像转化为可见光影像以供使用者观察。
1、接受样本。
2、核对编号,沟通切面以及拍照要求。
3、电镜制样。
4、镜下预览观察样本。
5、正式实验拍照。
动植物组织取材流程及要求:
1、取材要求:
(1)动物麻醉后,快速取出需要检测的组织(研究的目的区域),将组织切成1*1*1mm左右小块,固定于2.5%戊二醛固定液4℃过夜固定。
(2)植物组织除麻醉外,其他操作相同。组织投入固定液后需要进行真空抽气让组织沉底,如无条件抽气可用滤纸将组织塞进固定液内,组织不能漂浮在固定液表面。
2、取材流程:
(1)组织:新鲜组织确定取材部位,尽量减小牵拉、挫伤与挤压等机械损伤,1-3分钟内取样,取样组织1mm3大小。取材前可提前准备装有电镜固定液的培养皿,将小组织块离体取下后立即投入培养皿内,用手术刀在培养皿的固定液中进行切割成1mm3的小组织块。再将切割好的小组织块转移至装有新的电镜固定液的EP管内继续固定,室温固定2小时,再转移至4℃保存。
(2)保持低温环境:为降低自溶酶活性,最好在4℃低温条件下取材,容器和器械预冷;将修整好的标本块放入戊二醛固定液后,普通4℃冰箱保存。
3、特殊组织取材:客户根据实验目的采取合理固定方式。脑组织,建议采取灌注固定方法,充分灌注固定后,按照取材流程留取目的区域,将目的区域固定于2.5%戊二醛固定液中,4℃冰箱保存。
培养细胞取材:
1、对于单层贴壁细胞的透射电镜观察制样方法主要由三种:消化离心法、刮除离心法、原位包埋法。
(1)消化离心法:
a、确认细胞数量充足(离心后细胞团约1-2个芝麻大小)。
b、电镜专用 2.5%戊二醛固定液。
c、常规胰酶消化细胞,用完全培养基终止消化,离心收集细胞悬液。把细胞悬液置入洁净 1.5ml 尖头 EP 管内。
d、1000rpm 离心5-10min ,弃去上清,离心后在 ep 管底细胞沉淀成团(细胞团约1-2个芝麻大小)。
e、弃去上清,留取致密细胞团,缓慢注入1ml 常温 2.5%戊二醛固定液,用牙签挑起,使细胞沉淀不要沉底,室温避光固定5min,转入4℃保存。
(2)刮除离心法:
a、确认细胞数量充足(离心后细胞团约1-2个芝麻大小),直接倒出培养液后,弃去多余培养基,迅速加足量常温 2.5%戊二醛固定3-5min(戊二醛完全浸没细胞)。
b、随后用细胞铲或细胞刮成 45°倾角轻柔刮下细胞。顺着一个方向,不要来回刮细胞。
c、将细胞悬液全部转移到1.5ml 尖头 EP 管内。
d、转速1000rpm 离心 5min-10min,弃去上清。
e、细胞沉淀成团(细胞团约1-2个芝麻大小)注入1ml 常温 2.5%戊二醛固定液,用牙签挑起,使细胞沉淀不要沉底,转入4℃保存。
(3)原位包埋法:
如果是观察细胞连接,需要用到此特殊方法,是将细胞培养在小玻璃盖玻片上,然后连同小盖玻片一起进行固定,脱水等常规操作,具体要求请咨询。
请客户明确观察的目的,选择合适的固定方法
消化离心法最简单易行,但是消化后细胞的形状结构不是培养状态下
刮除离心法细胞更加接近于培养状态,如果是实验设计中短时间内的干预和刺激细胞,可以选择用刮除离心法,此方法会机械损伤细胞。
原位包埋法可较大程度的保持细胞的贴壁生长状态,但是操作复杂。
明确观察的目的,选择合适的固定方法:
消化离心法最简单易行,但是消化后细胞的形状结构不是培养状态下,如果实验设计是长时间干预并且细胞对胰酶不敏感,可以选择用消化离心法。
刮除离心法细胞更加接近于培养状态,如果是实验设计中短时间内的干预和刺激细胞,并且对细胞形态没有要求的,可以选择用刮除离心法,此方法要注意避免机械损伤细胞,保持细胞的完整性。
原位包埋法可较大程度的保持细胞的贴壁生长状态,但是操作复杂。
2、悬浮细胞:直接将细胞悬液全部转移到1.5ml 尖头 EP 管(或者15ml尖底离心管)内,转速1000rpm离心5分钟成团(细胞团大小约一个绿豆大小),轻轻吸去上清液(切勿丢失细胞),再沿管壁缓缓加入1ml新预冷2.5%戊二醛,随后置于4℃冰箱固定保存。
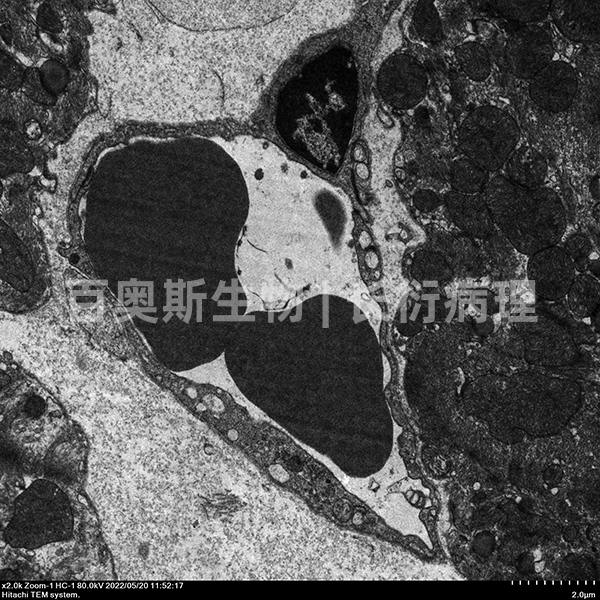
血管+血管内皮细胞

心肌细胞肌节+线粒体
1、客户提供材料要求:
(1)按照标准方法取材固定的实验样本(固定在戊二醛固定液中的样品)。
(2)客户需要提供拍照的参考图或者文献,切面要求,明确拍照区域、要求、拍照标尺。
(3)在保存和运输过程中固定液切勿冷冻结冰。
(4)带有磁性样本不能检测。
(5)非常规样本以及特殊拍照要求,请及时沟通。
2、制备样本时间:
(1)实验室收到样本后,透射电镜在3-4周(20个工作日)左右拍照。
(2)如果制样过程中遇非人为因素影响,时间会适当延长。
3、实验室拍照交付内容:
(1)每个样本拍照10-15张图片,如果需要采集更多图片,或者实验结束后提出新的观察要求,需要额外收取拍照费用,每张图片20元,上机费100元/例。
(2)公司可提供线上共享拍照桌面,实时共享拍照过程,如有需要,请联系各区域销售。



 关注百奥斯公众号
关注百奥斯公众号
 打开百奥斯小程序
打开百奥斯小程序